ДЛЯ ЛЕЧЕНИЯ ЛЕЙКОЗОВ
Назад в рубрику 
«Способ определения наличия остаточных опухолевых клеток при лечении Про-B (CD10¯) субтипа острого лимфобластного лейкоза у ребенка» (патент Республики Беларусь № 20998, МПК (2006.01): G 01N 33/533, G 01N 33/577; авторы изобретения: Л.В.Мовчан, М.В.Белевцев, Т.В.Шман; заявитель и патентообладатель: Государственное учреждение «Республиканский научно-практический центр детской онкологии, гематологии и иммунологии»).
Изобретение относится к медицине, к иммунологии и гематологии, а именно — к способу оценки эффективности противоопухолевой терапии у детей с острым лимфобластным лейкозом из предшественников B-лимфоцитов (ВП ОЛЛ) при Про-B (CD 10-ВП ОЛЛ) субтипе.
Как поясняется авторами, динамика количества опухолевых клеток в костном мозге (КМ) во время индукционной терапии является важной информацией, отражающей ответ на терапию и риск возникновения рецидива во время лечения острого лимфобластного лейкоза у детей. В настоящее время исследования, проводимые для оценки прогностических факторов возникновения рецидивов при острых лейкозах, показывают, что достижение цитоморфологической ремиссии (менее 5 % бластных клеток в КМ) на этапах терапии не является абсолютным критерием прогноза в отношении рецидива заболевания. Это связано с тем, что пациенты с ОЛЛ, находясь в гематологической ремиссии после терапии, могут сохранять в КМ до 1010 опухолевых клеток (остаточные опухолевые клетки — ООК), обнаружение которых возможно с использованием более чувствительных и специфичных способов. К современным способам оценки уровня ООК относится способ полимеразной цепной реакции (определение химерных онкогенов и/или реаранжировок генов иммуноглобулинов и Т-клеточного рецептора) и определение аберрантных иммунофенотипических характеристик опухолевых клеток с использованием проточной цитофлуориметрии). Мониторинг ООК с использованием техники многопараметрической проточной цитометрии является перспективным и наиболее предпочтительным способом оценки эффективности терапии, а также прогнозирования рецидивов на ранних этапах терапии детей с ОЛЛ. Данный способ основан на выявлении лейкоз-ассоциированного иммунофенотипа (ЛАИФ) опухолевых клеток на момент постановки диагноза и идентификации его в ходе терапии среди нормальных гемопоэтических клеток КМ. Критерием позитивности содержания ООК в образце является наличие группы клеток с ЛАИФ в количестве ≥ 0,01 %. Таким образом, количество и комбинации используемых для детекции остаточных опухолевых клеток моноклональных антител (МКА) являются важными факторами для адекватного анализа.
Предложенный авторами способ иллюстрируется следующими фигурами.
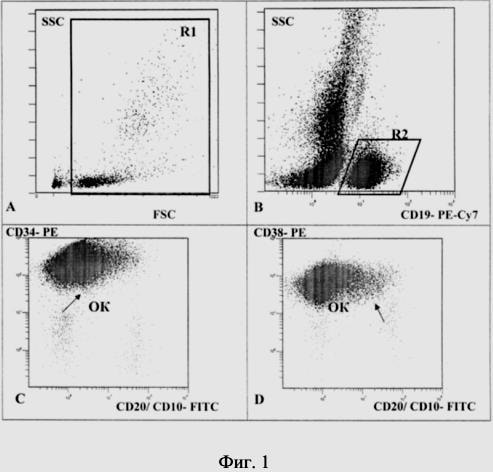
На фиг. 1 показан пример выделения регионов, необходимых для определения ЛАИФ и оценки ООК, где исходный регион (R1) устанавливают на точечном графике прямого и бокового светорассеяния — FSC/SSC для учета жизнеспособных клеток (фиг. 1A). Далее, на графике CD19/SSC устанавливают второй регион (R2), который выполняет заданный критерий R1 и включает все CD19 + клетки (фиг. 1B). Последующие графики, отражающие различные комбинации МКА согласно панели, выполняют заданный критерий R2. На приведенных графиках по аберрантной экспрессии МКА проводят анализ и подсчет клеток с ЛАИФ (фиг. 1C, 1D).
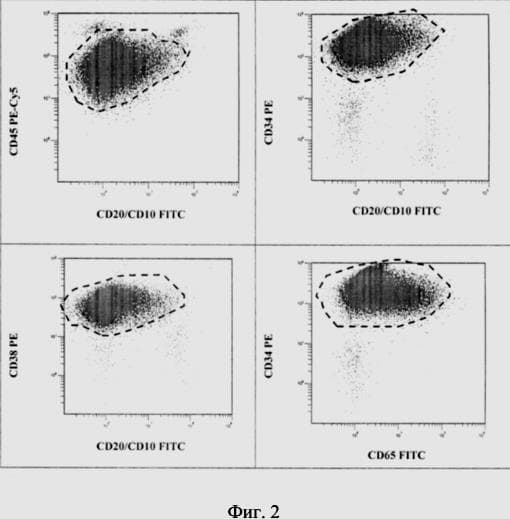
На фиг. 2 представлен пример определения индивидуального ЛАИФ опухолевых клеток пациента П. с использованием разработанной панели МКА для Про-B ОЛЛ (CD 10-ВП ОЛЛ). По аберрантной экспрессии исследуемых маркеров оценивают иммунофенотипическую характеристику лейкемических клеток, которую в дальнейшем используют в качестве примера для оценки ООК в КМ пациента на этапах терапии. На данном примере опухолевые клетки характеризуются сниженной экспрессией маркера CD45 и CD38, отрицательной экспрессией маркеров CD20, CD10, высокой экспрессией CD34 и гетерогенной экспрессией антигена CD65.
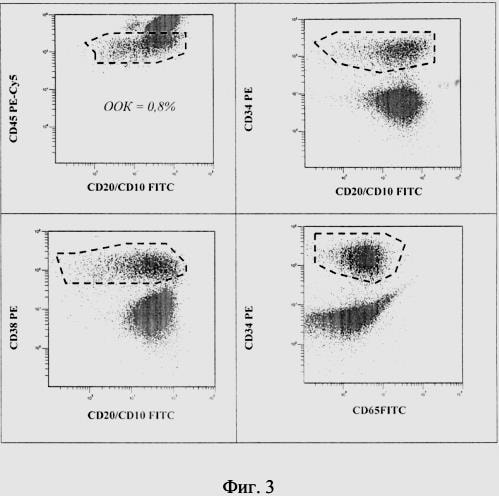
На фиг. 3 представлен пример оценки ООК у пациента П. на 15-й день индукционной терапии. На основании вышеописанной характеристики ЛАИФ (а также с учетом возможности изменения уровня экспрессии иммунофенотипических маркеров под действием глюкокортикоидов, применяемых в ходе индукционной терапии) идентифицируют опухолевые клетки среди нормальных гемопоэтических клеток костного мозга и проводят их количественный подсчет. У данного пациента уровень ООК составляют 0,8 %.
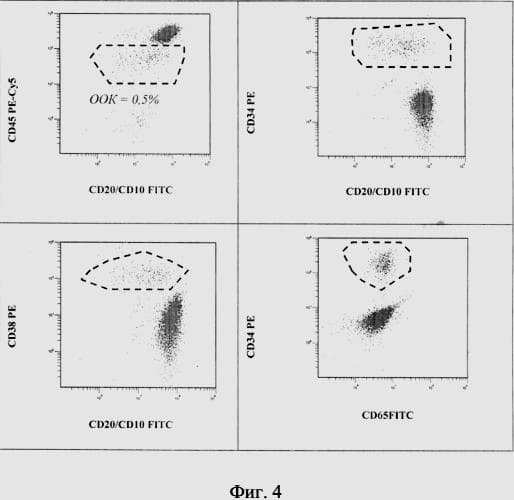
На фиг. 4 проиллюстрирован пример оценки ООК у пациента П. на 36-й день индукционной терапии. На основании вышеописанной характеристики ЛАИФ (а также с учетом изменения уровня экспрессии иммунофенотипических маркеров) идентифицируют опухолевые клетки среди нормальных гемопоэтических клеток КМ и проводят их количественный подсчет. У данного пациента на 36-й день терапии уровень ООК составляет 0,5 %.
Таким образом, как резюмируется авторами, предложенный ими способ является быстрым, информативным, надежным, позволяет с высокой степенью специфичности проводить оценку уровня остаточных опухолевых клеток в образцах костного мозга пациентов с Про-B (CD 10-ВП ОЛЛ) иммунологическим вариантом ВП ОЛЛ. Полученные результаты позволяют идентифицировать пациентов с высоким риском развития рецидива от тех, которые могут оставаться в полной ремиссии, а также проводить дополнительную стратификацию пациентов на ранних этапах противоопухолевой терапии с целью ее усиления для элиминации остаточного опухолевого клона и предотвращения развития рецидива или ослабления для снижения побочных эффектов. Разработаный способ может быть рекомендован для использования в медицинских учреждениях.